電解水制氫主要原理為水分子在直流電的作用下被解離生成氧氣和氫氣,分別從電解槽陽極和陰極析出。電解水制氫是一種高效、清潔的制氫技術,其制氫工藝簡單,產品純度高,氫氣、氧氣純度一般可達99.9%,是最有潛力的大規模制氫技術之一。水分解反應可以分為析氧反應(OER)和析氫反應(HER)兩個半反應,具體的機制如下:
氫作為一種能量密度高的零碳能源載體,被認為是一種很有前途的可持續能源。電解水裂解制氫技術已受到廣泛關注。其中,析氧反應(OER)涉及多電子轉移過程,動力學反應較慢,是制約整個水電解裝置效率的關鍵因素。通過對其反應機理的研究,可以從理論上設計出更高效的催化劑材料。OER機制涉及中間體的吸附和解吸,即OHads→Oads→OOHads→O2ads過程(吸附產物演化機制,AEM)。在堿性和酸性介質中,OER機制包括四個步驟(公式1到12)(每個步驟都與一個電子耦合),并涉及多個中間產物(OHads, Oads, OOHads和O2ads)。在堿性和酸性介質中,OER反應所需吉布斯自由能為4.92 eV(式6或式12),中間兩步反應所需吉布斯自由能為3.2 eV(式2和3或式9和10)。如果這兩個步驟中的一個需要較低的吉布斯自由能,那么它對應于另一個步驟中較高的吉布斯自由能過程。吉布斯自由能高的對應步驟為OER速率決定步驟(RDS),反之亦然。
堿性條件下OER的步驟如下:
OH- + * → OHads + e- (1)
OHads + OH- → Oads + H2O + e- (2)
Oads + OH- → OOHads + e- (3)
OOHads + OH- → O2ads + H2O + e- (4)
O2ads → O2 + * (5)
Overall: 4OH- → 2H2O + O2 + 4e- (6)
酸性條件下OER的步驟如下:
H2O + * → OHads + H+ + e- (7)
OHads → Oads + H+ + e- (8)
Oads + H2O → OOHads + H+ + e- (9)
OOHads → O2ads + H+ + e- (10)
O2ads → O2 + * (11)
Overall: 2H2O → 4H+ + O2 + 4e- (12)
其中*表示催化劑表面的活性位點,“ads”表示中間產物(OHads, Oads, OOHads, O2ads)的吸附狀態。
通常,在金屬(M)催化劑(包括貴金屬和過渡金屬)催化的OER過程中,M-O鍵相互作用對催化劑表面中間體的穩定有顯著作用,對整體電催化效率有顯著影響。在堿性和酸性介質中,OER反應機理可以寫成如下(中間綠色箭頭表示生成氧的可能性,而不是M-OOH中間體)(詳見圖1) 【1】。
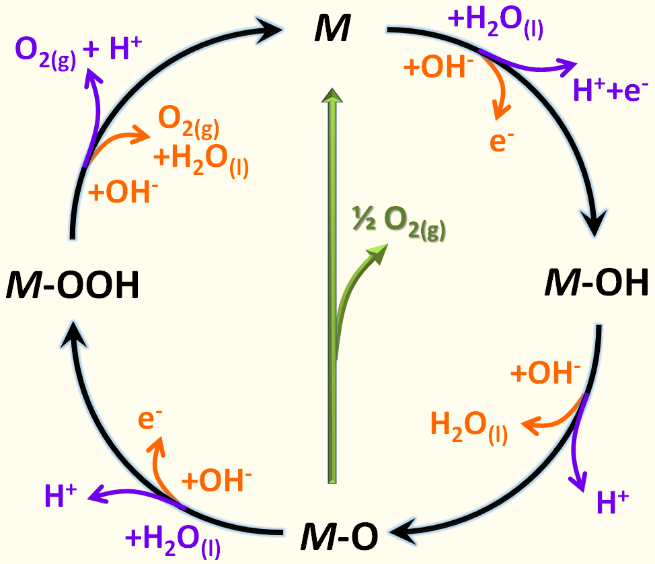
圖1 OER機理示意圖【1】。
在標準條件下,OER的熱力學平衡勢為1.23 V,但在實際反應過程中存在阻礙反應的不利動力學因素,還需要一個額外的勢,即過電勢。如上所述,熱力學中的這四個步驟都是非自發的,需要大量的能量才能進行下一步。能量勢壘與OER的每一步密切相關,阻止了動力學,需要高過電位來克服能量勢壘。認為解決OHads和OOHads之間的能量關系是獲得低過電位理想條件的關鍵。
析氫反應(HER)的催化活性與氫氣(ΔGH*)的吸附自由能有關。HER可基于Volmer-Heyrovsky機制或Volmer-Tafel機制發生(如圖2所示) 【1】。在堿性(圖2A)或酸性(圖2B)介質中,HER的演化步驟相似。HER的第一步是在酸性介質中與H3O+發生Volmer反應生成H*,在堿性介質中與H2O發生Volmer反應生成H*(見公式13和16)。第二步是速率決定步驟(RDS),它取決于這些催化劑的活性(見公式14,15,17,18)。如Pt基催化劑,Tafel反應吸附H*和H*生成H2,而過渡金屬催化劑通常與H2O(堿性)或H+ 即H3O+(酸性)和H*反應生成H2。反應路徑不同的原因是Pt金屬上的ΔGH*接近于零,而過渡金屬上的ΔGH*非常高。
堿性條件下HER的步驟如下:
H2O + e- → OH- + Hads (Volmer) (13)
Hads + H2O + e- → OH- +H2 (Heyrovsky) (14)
or 2Hads → H2 (Tafel) (15)
酸性條件下HER的步驟如下:
H++e- + * → Hads (Volmer) (16)
Hads + H+ + e- → H2 (Heyrovsky) (17)
or 2Hads → H2 (Tafel) (18)
其中*表示催化劑表面的活性位點,ads表示中間體(Hads)的吸附狀態。
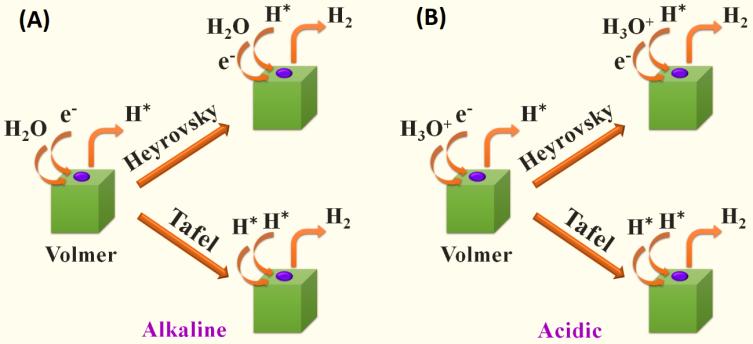
圖2 HER機理示意圖【1】。
氫的吸附能力是設計氫能電催化劑時需要考慮的重要因素之一。例如,PtSex單層非晶催化劑表現出優異的HER催化性能(過電位為0 V, Tafel斜率為39 mV dec-1),與純Pt表面催化劑(固相電位為0 V, Tafel斜率為37 mV dec-1)相似(見圖3) 【2】。PtSex催化劑具有高密度的單原子層結構(圖3A),在步驟2中表現出高度的Tafel反應機理(化學步驟)(圖3B)。特別是,理論計算表明,與晶體結構催化劑相比,非晶態超薄結構可以大大提高催化劑的氫吸附性能。其中單層非晶PtSex催化劑的ΔGH*在0 eV附近,原始結晶PtSe2催化劑的ΔGH*高于1 eV。其他非晶催化劑(如非晶Pd量子點)在HER (Tafel斜率為30.0 mV dec-1)中也表現出類似的增強效果【3】。
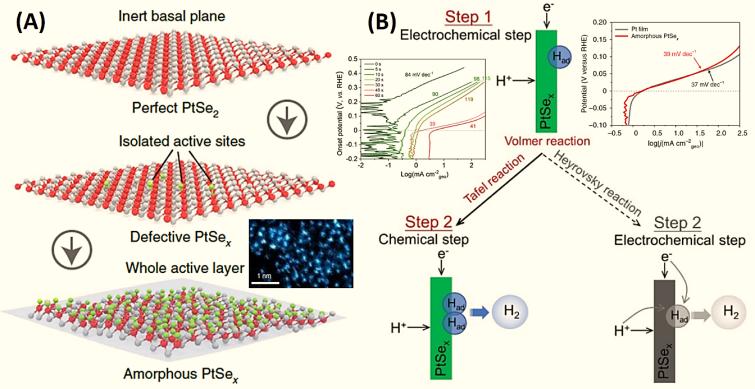
圖3 PtSex催化劑及其HER機制示意圖【2】。

Paperback ISBN: 9 7 8 - 0 - 4 4 3 - 1 9 2 5 6 - 2
eBook ISBN:
https://www.sciencedirect.com/book/9780443192562/nanostructured-materials

https://doi.org/10.1016/B978-0-443-19256-2.00003-X
https://doi.org/10.1016/B978-0-443-19256-2.00004-1
https://doi.org/10.1016/B978-0-443-19256-2.00006-5
https://doi.org/10.1016/B978-0-443-19256-2.00017-X
https://doi.org/10.1016/B978-0-443-19256-2.00030-2
https://doi.org/10.1016/B978-0-443-19256-2.00033-8
(可以通過上述doi網址,到“小木蟲”論壇或“科研通”網站免費互助下載)
納米材料是指材料的基本單位是三維的,至少一個維度的尺寸在1~100 nm的范圍內。高效利用能源、生態友好的環境體系和技術在全球可持續發展中發揮著重要作用。這些多功能納米結構材料(即納米材料)具有優異的性能,可以滿足能源開發和環境修復的實際需求。
能源和環境的可持續發展是當今世界人類社會的兩大戰略。隨著全球經濟的發展,人們對能源的需求日益增長,發展新能源勢在必行;同時,在技術發展過程中加強環境保護和生態修復也是當務之急。納米材料具有獨特的力學、電學、磁學、光學、化學和催化等性能,為能源開發和環境保護開辟了新的研究和應用領域。目前,各種金屬或非金屬納米材料在能源(能量存儲和轉換)和環境(環境保護)相關技術應用中發揮著重要作用。能源和環境應用通常涉及納米材料的物理化學反應過程(例如,電化學反應、光化學反應或熱化學反應)。
大多數納米非金屬材料(如碳、磷)和納米金屬材料(包括過渡金屬、貴金屬及其合金、氧化物、氮化物、碳化物、硫化物、磷化物等)。可增強上述反應過程中的反應或催化效率。闡明納米材料的結構特征與其反應或催化活性之間的關系在能源開發和環境修復中具有重要意義。構效關系往往取決于納米材料的表面性質和結構效應,如尺寸效應、電子效應、幾何效應、尺寸效應、晶體效應、限制效應、界面效應、協同效應等。特別是,如何通過電子結構將這些效應與物理化學性質聯系起來,是揭示納米體系構效關系的根本途徑。因此,深入了解納米材料的物理化學基礎,對于合理設計高效實用的納米材料是非常重要的。這是納米能源和環境科學領域的一個緊迫和核心的科學問題 (詳見圖1-1、圖1-2、圖1-3)。
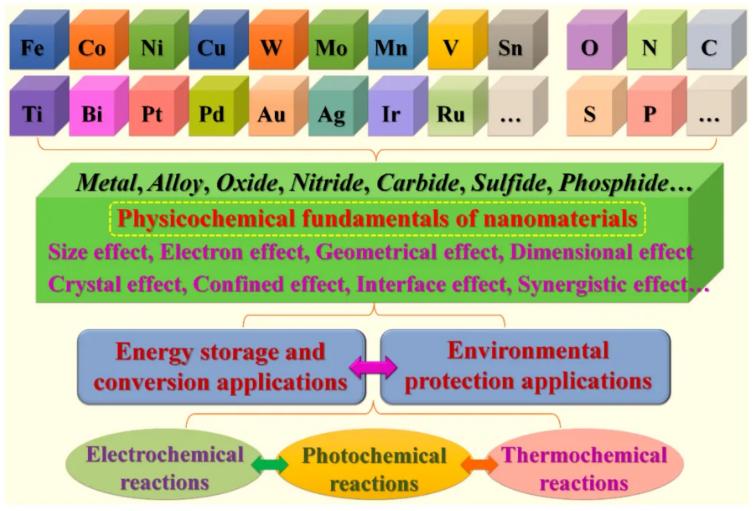
Fig. 1-1 Categories and structural effects of nanomaterials for energy and environmental applications.
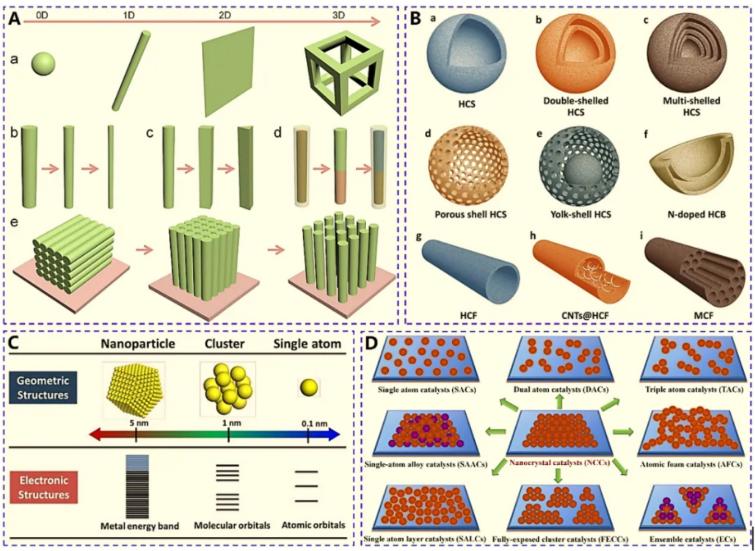
Fig. 1-2 (A) Schematics of nanostructures: (a) 0D to 3D nanostructures, variable structure parameters of (b) size, (c)morphology, (d) heterojunction, (d) spatial arrangement; (B) Schematics of nanostructures: (a-c) different-shell hollow nanospheres, (d, e) porous nanocages, (f) nanobowls, (g-i) hollow or porous nanowires; (C) Schematics of geometric and electronic structures; (D) Schematics of atomically-dispersed sub-nanostructures
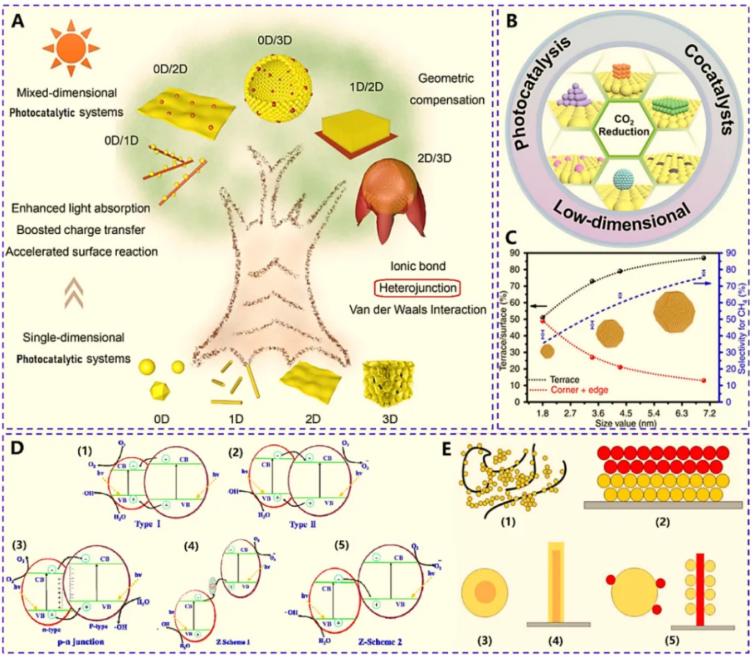
Fig. 1-3 (A) Schematics of nanostructured photocatalysts; (B) Schematics of nanostructured co-catalysts; (C) Schematics of size diminishing of co-catalyst; (D) Schematics of heterojunction charge transfer; (D) Schematics of heterojunction dimension structure .
納米材料的合理設計、可控合成和宏觀制備是其在能源和環境領域技術應用的前提。高效清潔的制備方法可以促進納米技術的可持續發展。納米材料的制備方法有很多種,一般這些方法可分為兩類:(1)“自上而下”的方法(主要是物理方法,如行星球磨、機械破碎、激光燒蝕、超聲波研磨等高能物理方法)和(2)“自下而上”的方法(主要是化學方法,如水熱/溶劑熱法, 共沉淀、溶膠-凝膠法、化學氣相沉積(CVD)、電沉積法等)(詳見圖5-1).
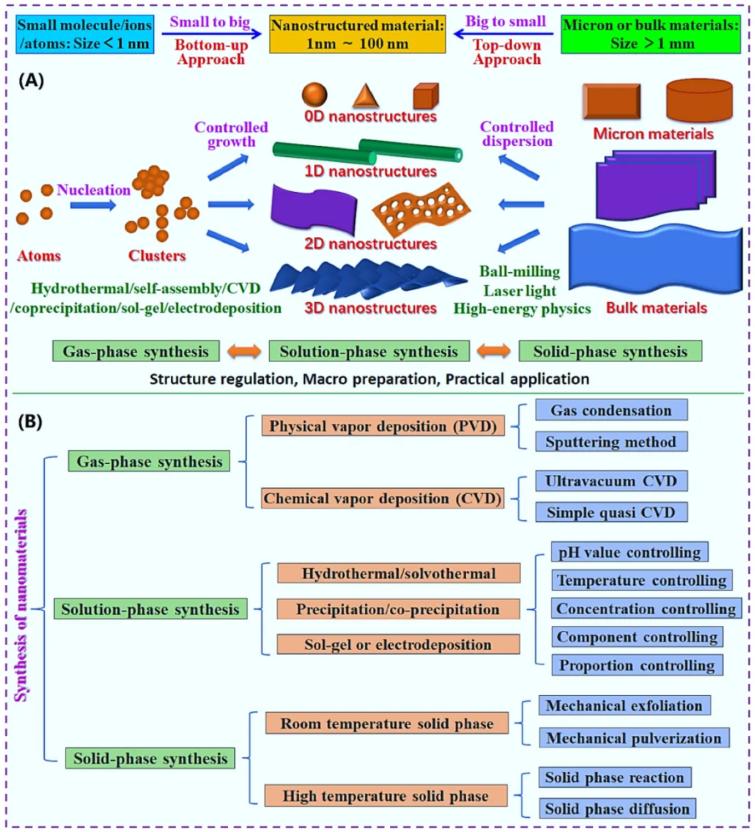
Fig. 5-1 (A) Preparation approaches of nanomaterials, and (B) Synthetic methods of nanomaterials.
參考文獻:
https://mp.weixin.qq.com/s/VMjfUu5yah6BGhAAQ6VtFg
https://mp.weixin.qq.com/s/qYIDWlApjcPXUh4QhL0AvA
https://mp.weixin.qq.com/s/ObT25cF2X92Ld65b8ANSpA

一、SCI論文寫作技巧匯總:
https://mp.weixin.qq.com/s/NALGXSC0X-HvpG_ffvyTRQ
https://mp.weixin.qq.com/s/LnvkSev5nKPzblUxwHxeXQ
https://mp.weixin.qq.com/s/Kv1KzlbpuRRTA6IvuaLW5Q
https://mp.weixin.qq.com/s/aURUmB-klQaPxXjdeToINg
https://mp.weixin.qq.com/s/IFN6BkzvwYEtp9PXdjSnGA