灣區時訊(編輯/劉秀 通訊員/文朝陽 陳鋆 鄭敏珊 )5月30日,中山大學腫瘤防治中心康鐵邦、武遠眾團隊在Science發表了題為“ASB7是H3K9me3表觀遺傳的負向調控分子”的研究論文。該研究揭示了ASB7擴增導致基因組不穩定并賦予腫瘤對PARPi敏感性,未來或可能為ASB7擴增型腫瘤患者提供新的治療方向。

組蛋白H3第9位賴氨酸三甲基化(H3K9me3)在維持異染色質結構、基因沉默和DNA損傷修復中發揮關鍵作用,H3K9me3失調可導致基因組不穩定及癌癥發生發展。H3K9me3的建立依賴于閱讀器HP1對已有修飾的識別,進而招募書寫器甲基轉移酶SUV39H1,后者通過甲基化鄰近組蛋白形成“讀-寫”正反饋循環。這一過程必須被嚴格調控,以防止H3K9me3過度沉積和異染色質異常形成,從而避免細胞損傷。但目前在高等生物體內限制這種正反饋以維持H3K9me3表觀遺傳穩態的具體機制仍不清楚。
研究團隊通過全基因組范圍的CRISPR-Cas9遺傳學篩選,發現E3泛素連接酶ASB7是H3K9me3的核心負調控因子。在調控機制上,H3K9me3的閱讀器HP1可招募ASB7至異染色質區域降解SUV39H1,這一過程受到細胞周期激酶CDK1-Cyclin B1嚴密控制,進入有絲分裂M期后,CDK1磷酸化ASB7并阻斷其對SUV39H1的泛素化降解,保障了H3K9me3在隨后細胞周期中的重建。該研究表明,在哺乳動物體細胞(含腫瘤細胞)中,“讀-寫-降解”平衡,而非經典的“讀-寫-擦除”平衡,可能是H3K9me3維持表觀遺傳穩態的基本機制。
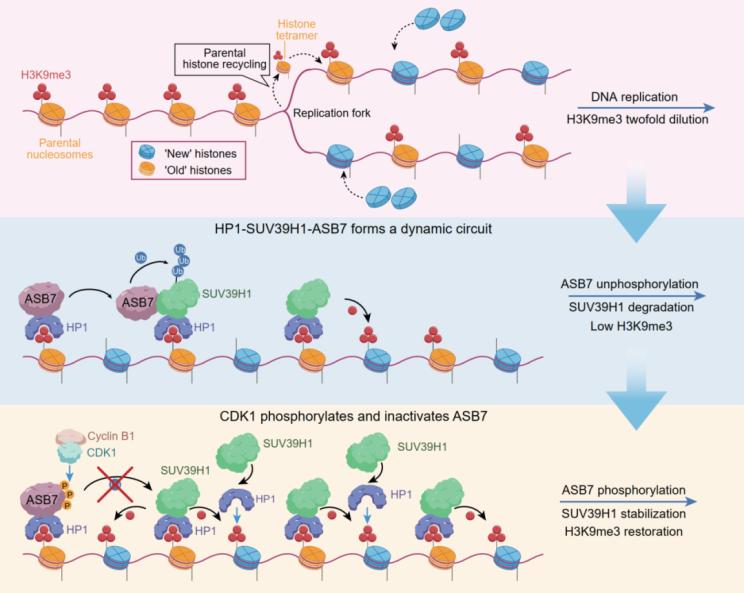
圖1. HP1-SUV39H1-ASB7介導的“讀-寫-降解”平衡控制H3K9me3表觀遺傳
DNA雙鏈斷裂損傷位點會發生H3K9me3修飾,進而激活下游級聯損傷修復通路。ASB7在多種腫瘤中呈現擴增狀態,這導致雙鏈斷裂位點的H3K9me3修飾水平不足,進而引起同源重組修復受損。細胞及動物實驗表明,ASB7高表達增強了腫瘤細胞對PARP抑制劑的敏感性。該結果提示,ASB7擴增型腫瘤患者可能是PARP抑制劑的潛在獲益人群。
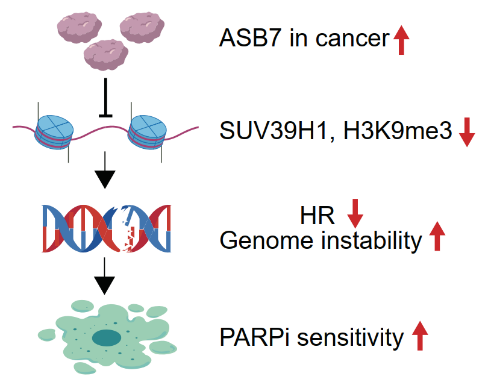
圖2. ASB7擴增賦予腫瘤對PARP抑制劑敏感性
中山大學腫瘤防治中心實驗研究部周立文特聘副研究員、陳振軒碩士研究生、中山大學醫學院鄒葉子博士研究生為該論文共同第一作者。中山大學腫瘤防治中心實驗研究部康鐵邦研究員、武遠眾副研究員為該論文通訊作者。
通訊作者簡介

康鐵邦
研究員,國家杰青、國家高層次人才。現任華南惡性腫瘤防治全國重點實驗室副主任、中國細胞生物學會腫瘤細胞生物學分會會長。以通訊作者在國際學術期刊上發表70多篇研究論文,包括Science, Nat Cancer, Nat Cell Biol, Cell Res(4篇), JCI (2篇), Nat Commun等,獲發明專利5項。先后主持4項國家基金委重點項目,擔任過科技部“973”項目、重點研發項目等課題負責人。

武遠眾
副研究員,從事腫瘤表觀遺傳研究,關注蛋白質修飾異常如何介導腫瘤細胞轉錄失調及基因組不穩定,并探索潛在靶向干預策略。相關成果以(共同)通訊、第一作者發表于Science,Nat Cancer,Cell Res,Nat Commun,NAR,STTT等雜志。
原文鏈接:https://www.science.org/doi/10.1126/science.adq7408?sessionid=511868241










評論 0