灣區科研 11月13日,中山大學腫瘤防治中心林東昕、鄭健研究組在Nature Genetics發表了題為“Super-enhancer RNA m6A promotes local chromatin accessibility and oncogene transcription in pancreatic ductal adenocarcinoma”的研究成果(點擊文末閱讀原文查看)。此項研究首次揭示了胰腺癌中seRNA甲基化修飾對組蛋白修飾和癌基因表達的調控,擴展了人們對超級增強子及其轉錄本功能新的認知。此種表觀轉錄組和表觀基因組的相互作用必定與其它類型癌癥也有關系,因此可能開辟一個癌癥中基因表達調控新的研究方向。

N6-甲基腺嘌呤 (m6A) 是哺乳動物RNA最常見的修飾,對多種生理和病理過程中基因表達有廣泛的影響。中山大學腫瘤防治中心林東昕、鄭健研究組前期研究發現,N6-腺嘌呤甲基化的mRNA可解除DNA上的甲基化促進染色質開放,這個表遺傳機制在激活食管癌的癌基因表達中起重要作用(Nature Genetics, 2022)。轉錄組中的另一類RNA即染色質相關RNA也可以被甲基化,但其生物學作用所知甚少。超級增強子產生的RNA (seRNA)是重要的染色質相關RNA,以前被認為是無功能的轉錄噪聲。但隨著對其深入研究,現已知道超級增強子可通過其seRNA對基因表達起調控作用。既然seRNA對基因表達有調控作用,那么其m6A修飾到底會有什么樣的作用?這個問題懸而未決。最近有研究報道,在小鼠胚胎干細胞中,seRNA-m6A可改變染色質狀態和基因表達。但seRNA-m6A在人類細胞中是否有類似的作用?在疾病狀態如癌細胞中它的作用又如何?
超級增強子表達seRNA具有顯著的組織和細胞特異性。該研究以胰腺癌為對象,發現胰腺癌細胞的seRNA-m6A含量顯著高于正常細胞,其原因是由于胰腺癌細胞高表達m6A甲基轉移酶METTL3的協同因子CFL1。高表達的CFL1使seRNA一轉錄出來就被m6A修飾。m6A-seRNA隨后被YTHDC2識別,后者招募組蛋白甲基轉移酶MLL1,使鄰近染色質區域的組蛋白H3K4三甲基化增加,導致局部染色質開放使癌基因表達上調。
該研究先通過收集公共數據庫中正常胰腺細胞、胰腺組織和胰腺癌的H3K27ac染色質免疫共沉淀測序數據,鑒定了在胰腺中激活的超級增強子位置,然后通過整合98例胰腺癌與癌旁正常組織樣本的m6A測序數據,描繪了胰腺癌中seRNA-m6A圖譜,發現在胰腺癌組織中seRNA-m6A含量顯著高于正常組織,這歸因于在胰腺癌中高表達的RNA結合蛋白CFL1。研究者運用體外培養的細胞,進行了生化、分子生物學及細胞生物學等實驗,證實CFL1是RNA甲基轉移酶METTL3的協同分子,它招募METTL3到與其結合的seRNA進行m6A甲基化。顯著增加的seRNA-m6A被m6A閱讀蛋白YTHDC2識別,后者同時招募組蛋白甲基轉移酶MLL1,使其鄰近區域的染色質組蛋白H3K4三甲基化增加,導致染色質開放。
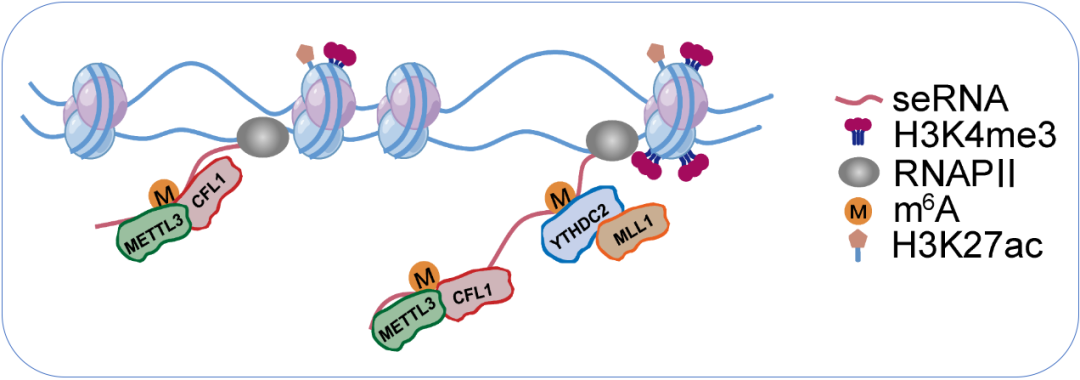
CFL1-YTHDC2-MLL1調控軸促進胰腺癌染色質開放和癌基因轉錄的模式圖
該研究運用了先進的ATAC-seq、RNA-seq和m6A-seq等多組學和多組學數據的整合分析策略,除了揭示CFL1-YTHDC2-MLL1表觀調控軸可促進染色質開放和相應癌基因表達外,還積累了大量可靠數據,為全面的泛癌研究打下了重要基礎。因為超級增強子表達具有顯著的細胞和組織特異性,泛癌研究對于進一步闡明這種表觀轉錄組和表觀基因組串擾在腫瘤形成和進展中的生物學作用具有重要意義。Nature Genetics同期還發表了該工作的研究簡報(Research Briefing)。
中山大學腫瘤防治中心博士研究生李芮、博士研究生趙鴻哲和副研究員黃旭東為文章的共同第一作者;鄭健研究員和林東昕院士為該研究論文的共同通訊作者。
中山大學腫瘤防治中心林東昕、鄭健研究組自2015年成立以來,長期專注于腫瘤基因組學和腫瘤表觀遺傳學等方面的研究。團隊長期招聘博士后、特聘副研究員和研究員,熱誠歡迎有腫瘤學、生物信息學、生物化學和分子生物學等背景的人才加入。
聯系方式:
zhengjian@sysucc.org.cn
通訊員/陳鋆
責任編輯/劉秀










評論 0